Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập – Trường THPT Thành Phố Sóc Trăng
Kim loại tác dụng với nước : kim chỉ nan, ví dụ và bài tập
Trên thực tế, một số kim loại tác dụng với nước khác là từ Mg trở về sau trên bảng tuần hoàn hóa học. Chẳng hạn Al, Zn, vẫn tác dụng và tạo khí H2. Tuy nhiên trong chương trình hóa học lớp 9 chúng ta không tìm hiểu các kim loại nặng như Al, Zn mà là 5 kim loại bao gồm cả kim loại kiềm và kiềm thổ. Chúng ta hãy cùng tìm hiểu sâu hơn trong bài viết này nhé!

Nội dung chính
Bạn đang đọc: Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập – Trường THPT Thành Phố Sóc Trăng
Bạn đang xem : Kim loại tác dụng với nước : kim chỉ nan, ví dụ và bài tập
- Phương trình hóa học kim loại tác dụng với nước
-
Phân dạng bài tập kim loại tác dụng với nước
- Dạng 1: Xác định lượng bazo và hidro sau phản ứng
- Dạng 2: Trung hòa lượng bazo bằng một lượng axit thêm vào. Xác định lượng muối tạo thành sau phản ứng.
- Dạng 3: Tính lượng bazo mới hoặc muối mới tạo thành sau khi trung hòa dung dịch sau phản ứng
- Bài tập kim loại tác dụng với nước
Phương trình hóa học kim loại tác dụng với nước
Như đã trình làng, kim loại kiềm và kiềm thổ sẽ tác dụng được với nước ở điều kiện kèm theo thường. Trong chương trình này ta cùng khám phá 1 số ít kim loại phổ cập như Ca ( Canxi ), Ba ( Bari ), Na ( Natri ). Phương trình phản ứng tạo bazo và khí H2 thoát ra .

Công thức tổng quát kim loại tác dụng với nước theo hóa trị :
Hóa trị I :

Hóa trị II :

Phân dạng bài tập kim loại tác dụng với nước
Sau khi tìm hiểu và khám phá đặc thù hóa học của kim loại khi tác dụng với nước, dưới đây là một số dạng bài tập mà những em liên tục gặp trong quy trình học cũng như thi tuyển .
Dạng 1: Xác định lượng bazo và hidro sau phản ứng
Cho phản ứng giữa kim loại với nước. Xác định lượng bazo tạo thành và khí Hidro bay lên. Ở dạng toán này, ta sử dụng 1 số ít công thức sau để tìm nhanh số mol những chất vì đây là một dạng toán khá đơn thuần :
- nOH trong bazơ =2
- Định lý về hóa trị: (Hóa trị kim loại) x (số mol kim loại) = 2 x (số mol của khí H2 thoát ra)
Dạng 2: Trung hòa lượng bazo bằng một lượng axit thêm vào. Xác định lượng muối tạo thành sau phản ứng.
Ở dạng toán này, học viên cần linh động vận dụng những định luật vào môn hóa học. Đặc biệt là định luật bảo toàn điện tích
- nH+ = nOH- = 2nH2
- Chẳng hạn như NaOH thì n(NaOH) = 2nH2.
- Khối lượng muối: m = M.n (với n là số mol của muối đó)
Dạng 3: Tính lượng bazo mới hoặc muối mới tạo thành sau khi trung hòa dung dịch sau phản ứng
Khác với dạng toán 2 ở chỗ bazo tạo thành thường sẽ là chất kết tủa. Do đó dữ kiện của đầu bài sẽ khác đôi chút tuy nhiên giải thuật cũng như giải pháp giải thì trọn vẹn giống .
Bài tập kim loại tác dụng với nước
Câu 1:
Tại sao khi cho vôi sống vào nước, ta thấy khói bốc lên mù mịt, nước vôi như bị sôi lên và nhiệt độ hố vôi rất cao hoàn toàn có thể gây nguy hại cho tính mạng con người của người và động vật hoang dã. Do đó cần tránh xa hố đang tôi vôi hoặc sau khi tôi vôi tối thiểu 2 ngày ? ( SGK )
Lời giải:
Như đã ra mắt thì Caxi ( Ca ) sẽ tác dụng với nước rất mãnh liệt ở điều kiện kèm theo thường. Phương trình hóa học :
Ca + 2H2 O — > Ca ( OH ) 2 + H2O
Phản ứng trên tỏa ra rất nhiều nhiệt, do đó làm cho dung dịch sôi lên. Bay hơi là những hạt Ca ( OH ) 2 rất nhỏ, lấm tấm tạo cảm xúc giống như khói mù trắng. Đây là dạng bài tập nhận biết hiện tượng kỳ lạ phản ứng hóa học .
Câu 2:
Khi cho 7,9 gam hỗn hợp gồm K và Ca vào nước thu được dung dịch X và 3,36 lít khí H2. Tính khối lượng của mỗi kim loại có trong hỗn hợp ?
Lời giải:
Gọi số mol của K, Ca có trong hỗn hợp lần lượt là a, b bằng phương pháp nhẩm ta có hệ phương trình sau:
39 a + 40 b = 7,9 ( 1 )
1. a + 2. b = 2. 3,36 / 22,4 ( 2 ) .
Giải hệ phương trình trên ta tìm được a = b = 0,1. Suy ra : mK = 3,9 ; mCa = 40
Từ ví dụ trên ta thấy việc nắm vững thực chất của phương trình phản ứng sẽ giúp tất cả chúng ta nhanh gọn thiết lập được mối liên hệ cũng như chiêu thức giải bài tập .
Câu 3: Hòa tan hoàn toàn 2,3 gam Na vào 120 gam H2O, sau phản ứng thu được dung dịch X và V lít khí H2 (đktc).
a ) Tính V ?
b ) Tính nồng dộ Xác Suất của dung dịch thu được ?
Lời giải:
a ) Áp dụng định luật bảo toàn điện tích ta hoàn toàn có thể tính nhanh như sau :
1. nNa = 2 nH2 à nH2 = 0,05 ; VH2 = 1,12 ( lít )
b ) Để tính được nồng độ Xác Suất của dung dịch ta cần xác lập những chất trong dung dịch cũng như khối lượng để có một hiệu quả đúng mực nhất .
Công thức được xác lập như sau : C % ( NaoH ) = [ mNaOH / mdd ]. 100 %
Ở đây vận dụng định luật bảo toàn nguyên tố sẽ cho tác dụng nhanh nhất : nNaOH = nNa = 0,1 à mNaOH = 4 gam
Từ đó ta thuận tiện tính được nồng động Tỷ Lệ của dung dịch là : 3,273 %
Câu 4: Cho 8,5g hỗn hợp Na và k tác dụng với nước thu được 3,36l khí hidro (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch Fe2(SO4)3 thu được m(g) kết tủa. Giá trị của m là:
Lời giải: Đây là một bài toán khả tổng quát được sưu tầm và minh họa cho dạng toán số 3.
Áp dụng định luật bảo toàn điện tích ta có :
nOH – = 2 nH2 = 2. = 0,3 mol .
Dễ dàng nhận thấy kết tủa trong bài toán này là : Fe ( OH ) 3 ( Vì Fe trong bài sống sót ở hóa trị III )
Do đó : nFe ( OH ) 3 = 0.3 / 3 = 0.1
Khối lượng tết tủa tạo thành là : m Fe ( OH ) 3 = 107 x 0,1 = 10.7 ( gam )
Vậy là chúng ta vừa tìm hiểu xong tất cả các vấn đề liên quan đến kim loại tác dụng với nước. Từ phương trình hóa học, bản chất phương trình và một số dạng bài tập rất căn bản. Nếu trong quá trình học tập, các em thấy có thắc mắc ở vấn đề kiến thức nào, hãy để lại comment bên dưới bài viết này để chúng tôi kịp thời sữa chữa. Chúc các em học tốt
Đăng bởi : trung học phổ thông Sóc Trăng
Chuyên mục: Giáo dục
Bản quyền bài viết thuộc trường trung học phổ thông Sóc Trăng. Mọi hành vi sao chép đều là gian lận !
Nguồn san sẻ : Trường trung học phổ thông TP Sóc Trăng ( thptsoctrang.edu.vn )
Source: https://thomaygiat.com
Category : Điện Nước
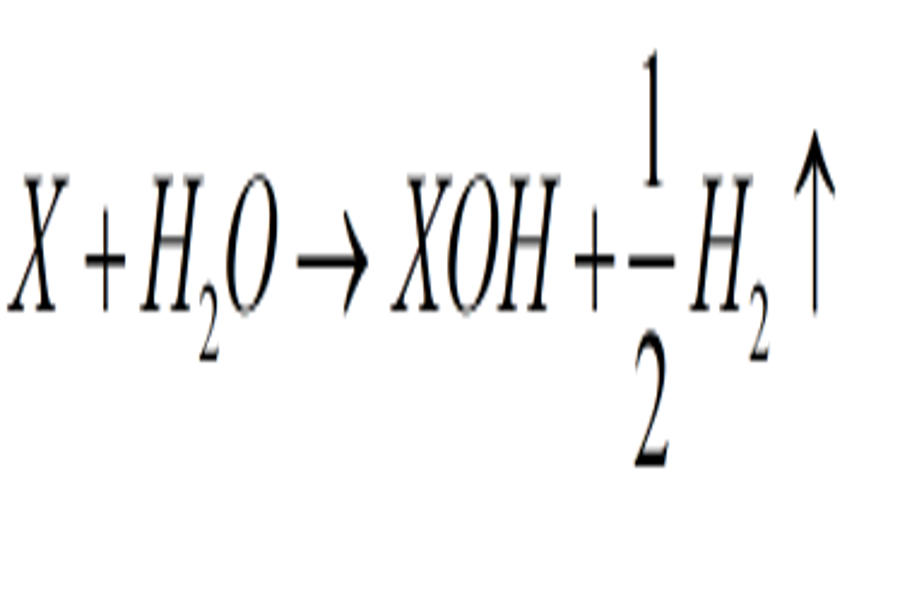

Tuyển dụng, tìm việc làm Thợ Điện tháng 10/2022 – Thợ Sửa Máy Giặt [ Tìm Thợ Sửa Máy Giặt Ở Đây ]
Tất tần tật những điều cần biết về việc làm thợ điện Ghé ngay JobsGO và nhận thông tin về hàng trăm vị trí việc…

Túi đựng đồ nghề Smato chuyên dụng dành cho thợ điện
Hỏi – Đáp 1 Bạn đang đọc: Túi đựng đồ nghề Smato chuyên dụng dành cho thợ điện Túi đựng đồ nghề Smato chuyên dụng…

Tuyển thợ điện nước tại vinh – Sửa Nhà Sơn Nhà 10 Địa Chỉ Uy Tín Tại Hà Nội
Bạn đang gia phú cần tìm Tuyển thợ điện nước tại vinh phát đạt nhưng chưa biết bá đạo tập 2 nơi nào hỗ trợ…

Top 20 tìm việc thợ điện nước tại cần thơ hay nhất 2022 – Sửa Nhà Sơn Nhà 10 Địa Chỉ Uy Tín Tại Hà Nội – Dịch Vụ Bách khoa Sửa Chữa Chuyên nghiệp
Tác giả: thosuadiennuoc.net Ngày đăng: 6/3/2021 Bạn đang đọc : Top 20 tìm việc thợ điện nước tại cần thơ hay nhất 2022 Xếp hạng:…

Tuyển Dụng, Tìm Việc Làm Quận Lê Chân, Hải Phòng Lương Cao T10/2022 – https://thomaygiat.com
Mục ChínhTiềm Năng Phát Triển Của Thị Trường Việc Làm Quận Lê Chân, Hải Phòng 1. Tổng quan thị trường việc làm tại Quận Lê Chân,…

Tìm việc làm thợ điện nước tại hà nội
Bạn đang chăm bé cần tìm Tìm việc làm thợ điện nước tại hà nội trường xuân nhưng chưa biết nhà quận 1 nơi nào…
![Thợ Sửa Máy Giặt [ Tìm Thợ Sửa Máy Giặt Ở Đây ]](https://thomaygiat.com/wp-content/uploads/sua-may-giat-lg-tai-nha-1.jpg)